Segundo uma antiga lenda romana, o sabão teve sua origem no Monte Sapo, local onde sacrificavam animais. Gorduras de animais sacrificados misturavam-se com cinzas oriundas da queima das madeiras utilizadas no processo de cozimento. Então, quando chovia, essa mistura era levada até as margens do rio Tibre. Essa mistura (gordura de animais e cinzas) era utilizada pelas mulheres para a lavagem de roupas5.
O carbonato de sódio (Na2CO3) foi e é um produto químico muito importante. A fabricação de sabão, vidro e papel, no contexto de avanço da Revolução Industrial, impulsionou a demanda por carbonato de sódio1. Porém, o fornecimento do produto não acompanhou a sua procura. O carbonato de sódio era obtido de cinzas extraídas de recursos naturais, como de certas madeiras e plantas marinhas1. Cinzas do arbusto Salsola soda (barrilha) eram provenientes do mediterrâneo, enquanto as cinzas de algas marinhas eram produzidas nas regiões costeiras da Escócia, Irlanda e Noruega.1,2
Em 1783, Luís XVI ordenou a Academia de Ciências que fosse aberto um concurso, com um prêmio de 2400 libras a quem desenvolvesse um processo de fabricação de carbonato de sódio a partir do sal (cloreto de sódio)1,2.
Nicolas Leblanc, químico e médico francês, reagiu sal com ácido sulfúrico para formar sulfato de sódio e ácido clorídrico, depois adicionou calcário e carvão para produzir sulfato de cálcio, dióxido de carbono e o produto principal, carbonato de sódio1. Nessa época, Leblanc trabalhava como cirurgião para o Duque de Orléans2. Em 1791, com apoio do Duque de Orléans, montou uma fábrica de carbonato de sódio em St. Denis, arredores de Paris, impulsionando o processo de obtenção industrial. Com a Revolução Francesa, o Duque de Orléans foi guilhotinado em 1793 e Leblanc foi obrigado a tornar públicos os detalhes de sua invenção. Leblanc nunca chegou a receber o prêmio pela sua descoberta1.
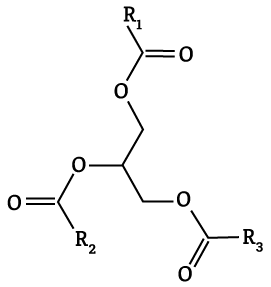
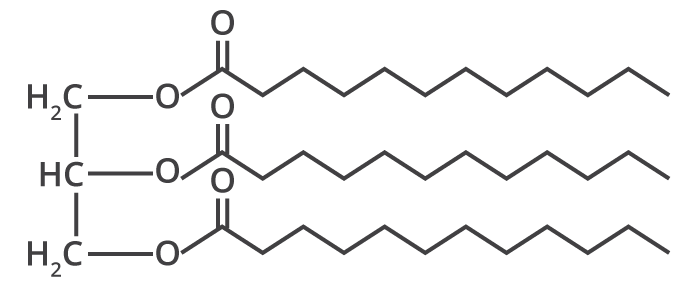
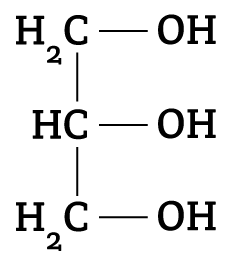
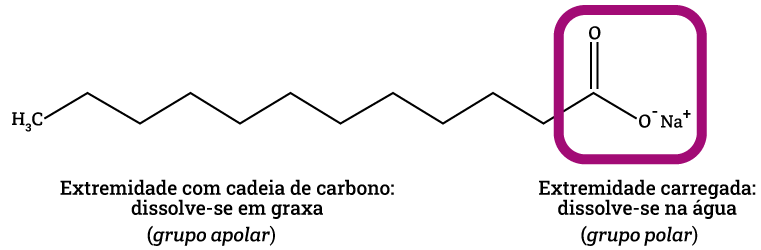
Outro avanço importante para a produção de sabões foi a elucidação da composição química das gorduras. Entre os anos de 1813 e 1823, o químico francês Michel Eugéne Chevreul elucidou a composição química das gorduras animais, mostrando que a formação do sabão era uma reação química e não uma simples mistura mecânica de gordura e álcali (substância com características básicas, )3,4.
O processo Leblanc foi um grande pilar da Indústria Química europeia durante o século XIX. No entanto, as limitações do processo Leblanc levaram à investigação de processos alternativos. A técnica Leblanc era extremamente poluente e desperdiçava matérias-primas.1 Na década de 1860, o químico belga Ernest Solvey desenvolveu um processo para produção de carbonato de sódio utilizando amônia, mais eficaz, menos poluente e mais barato que o de Leblanc. Esse processo ficou conhecido como processo Solvay1. Com ajuda de seu irmão Alfred, a primeira fábrica Solvay foi instalada em 1863 em Couillet, Bégica.1
A substituição do processo Leblanc pelo processo Solvey foi não ocorreu de forma imediata. Os dois processos coexistiram durante mais de quarenta anos1.
Atualmente, a fabricação de sabões e detergentes sintéticos compõem as atividades da indústria química.